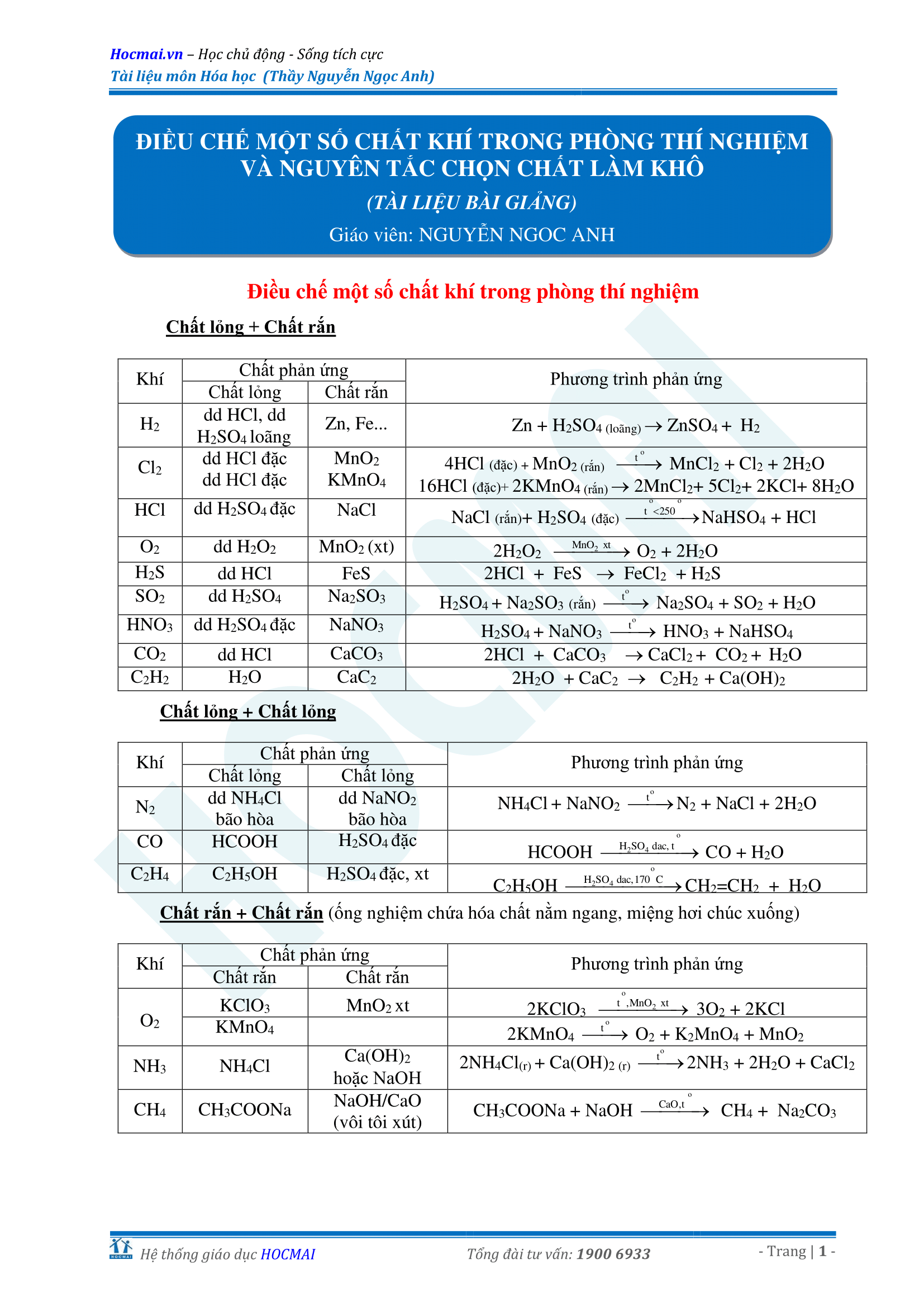
Công thức hóa học cơ bản THPT


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Bạn đang tìm kiếm các công thức hóa học cơ bản thường gặp trong chương trình hóa học THPT? Bài viết này sẽ tổng hợp những công thức quan trọng và thường xuyên xuất hiện trong các bài toán và đề thi, giúp bạn nắm vững kiến thức và giải quyết bài tập hiệu quả hơn.
Công thức tính toán hóa học
1. Công thức tính số mol (n):
Số mol (n) được tính theo công thức: n = m/M (trong đó: m là khối lượng chất (gam), M là khối lượng mol (g/mol))
2. Công thức tính nồng độ mol (CM):
Nồng độ mol (CM) được tính theo công thức: CM = n/V (trong đó: n là số mol chất tan, V là thể tích dung dịch (lít))
3. Công thức tính nồng độ phần trăm (%):
Nồng độ phần trăm (%) được tính theo công thức: C% = (mct/mdd) x 100% (trong đó: mct là khối lượng chất tan (gam), mdd là khối lượng dung dịch (gam))
4. Công thức tính hiệu suất phản ứng (H):
Hiệu suất phản ứng (H) được tính theo công thức: H = (Lượng chất thực tế thu được / Lượng chất lý thuyết) x 100%
Công thức hóa học của một số chất thường gặp
1. Axit:
HCl (Axit clohiđric), H2SO4 (Axit sunfuric), HNO3 (Axit nitric), CH3COOH (Axit axetic)
2. Bazơ:
NaOH (Natri hiđroxit), KOH (Kali hiđroxit), Ca(OH)2 (Canxi hiđroxit), Mg(OH)2 (Magie hiđroxit)
3. Muối:
NaCl (Natri clorua), K2SO4 (Kali sunfat), CaCO3 (Canxi cacbonat), CuSO4 (Đồng(II) sunfat)
4. Oxit:
CO2 (Cacbon đioxit), SO2 (Lưu huỳnh đioxit), Fe2O3 (Sắt(III) oxit), CuO (Đồng(II) oxit)
Xem thêm: bút cảm ứng điện dung
Sản phẩm hữu ích: định luật quán tính
Sản phẩm liên quan: định nghĩa đường sức từ