Bazơ không tan là gì? Các ví dụ và tính chất


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
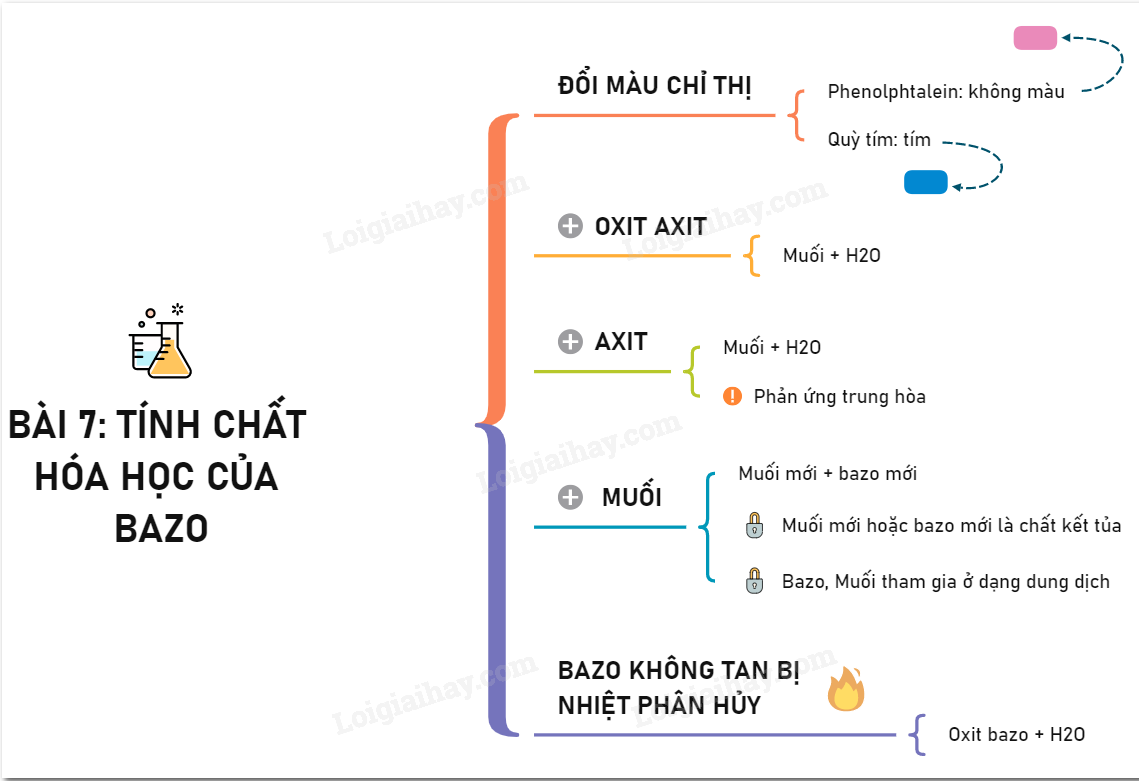
Bazơ không tan là những hợp chất bazơ không hòa tan trong nước. Chúng thường là các hidroxit của kim loại, ngoại trừ một số kim loại kiềm và kiềm thổ.
Các ví dụ về bazơ không tan
Nhóm kim loại chuyển tiếp:
Ví dụ bao gồm sắt(II) hidroxit (Fe(OH)2), sắt(III) hidroxit (Fe(OH)3), đồng(II) hidroxit (Cu(OH)2), nhôm hidroxit (Al(OH)3), kẽm hidroxit (Zn(OH)2) và nhiều hidroxit kim loại khác. Những bazơ này thường có màu sắc đặc trưng và kết tủa khi phản ứng xảy ra. Ví dụ, khi cho dung dịch NaOH vào dung dịch muối sắt(III) clorua, sẽ tạo ra kết tủa nâu đỏ của Fe(OH)3.Nhóm kim loại khác:
Một số bazơ không tan khác bao gồm magie hidroxit Mg(OH)2 (thường thấy trong sữa magnesia), và các hidroxit của nhiều kim loại khác thuộc nhóm IIA và IIIA trong bảng tuần hoàn.Tính chất của bazơ không tan
Tính chất vật lý:
Bazơ không tan thường tồn tại ở dạng chất rắn, không màu hoặc có màu sắc đặc trưng. Chúng không dẫn điện khi ở trạng thái rắn, nhưng có thể dẫn điện khi nóng chảy hoặc hòa tan trong một số dung môi khác. Chúng thường có dạng kết tủa khi được tạo thành trong dung dịch.Tính chất hóa học:
Mặc dù không tan trong nước, bazơ không tan vẫn có thể phản ứng với một số axit để tạo thành muối và nước. Đây là phản ứng trung hòa, ví dụ: Cu(OH)2 + 2HCl → CuCl2 + 2H2O. Một số bazơ không tan cũng có thể bị phân hủy bởi nhiệt, tạo thành oxit kim loại và nước. Ví dụ: Cu(OH)2 → CuO + H2O. Ngoài ra, một số bazơ lưỡng tính như Al(OH)3 có thể phản ứng với cả axit và bazơ mạnh.Sản phẩm hữu ích: avatar 3 người bạn thân
Sản phẩm liên quan: nito phân tử khối
Sản phẩm liên quan: sản phẩm của công ty adc
Sản phẩm hữu ích: chim ngũ sắc hót hay
Sản phẩm liên quan: đồ chơi treo nôi