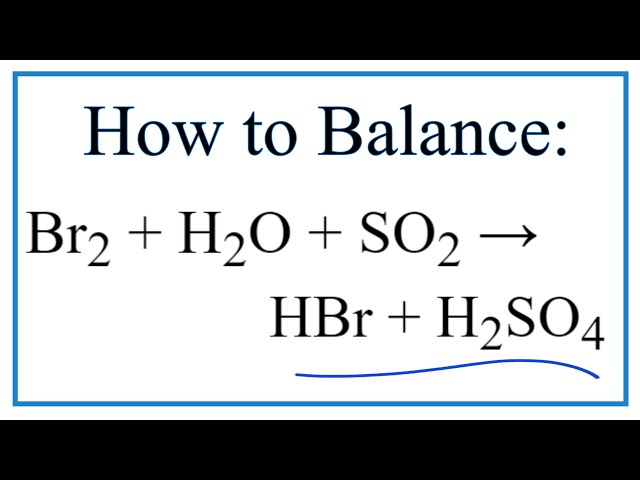
Phản ứng giữa Br2, SO2 và H2O

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa Br2, SO2 và H2O là một phản ứng oxi hóa khử, trong đó brom (Br2) bị khử thành ion bromua (Br-), và lưu huỳnh đioxit (SO2) bị oxi hóa thành axit sunfuric (H2SO4). Phương trình phản ứng cân bằng là: Br2 + SO2 + 2H2O → 2HBr + H2SO4
Cơ chế phản ứng
Sự oxi hóa khử
Trong phản ứng này, brom (Br2) đóng vai trò là chất oxi hóa, nhận electron từ lưu huỳnh đioxit (SO2). Lưu huỳnh đioxit (SO2) đóng vai trò là chất khử, nhường electron cho brom (Br2). Nước (H2O) đóng vai trò là môi trường phản ứng, giúp quá trình oxi hóa khử diễn ra dễ dàng hơn. Brom bị khử từ số oxi hóa 0 xuống -1, trong khi lưu huỳnh bị oxi hóa từ +4 lên +6.
Điều kiện phản ứng
Phản ứng này thường xảy ra ở điều kiện thường, tuy nhiên tốc độ phản ứng có thể được tăng lên bằng cách tăng nhiệt độ hoặc sử dụng chất xúc tác.
Ứng dụng
Phản ứng này có ứng dụng trong một số lĩnh vực hóa học, ví dụ như trong việc sản xuất axit sunfuric. Tuy nhiên, việc sản xuất axit sunfuric thường được thực hiện bằng phương pháp khác hiệu quả hơn.
Kết luận
Phản ứng giữa Br2, SO2 và H2O là một phản ứng oxi hóa khử quan trọng, minh họa rõ nét quá trình trao đổi electron giữa các chất. Hiểu rõ cơ chế và điều kiện phản ứng giúp chúng ta ứng dụng hiệu quả trong các lĩnh vực liên quan.
Sản phẩm hữu ích: ngựa ngủ đứng hay nằm
Sản phẩm hữu ích: sieu hoc vien 3d
Sản phẩm hữu ích: đôi dép lộc nga