Cấu trúc Lewis của Beryllium Chloride
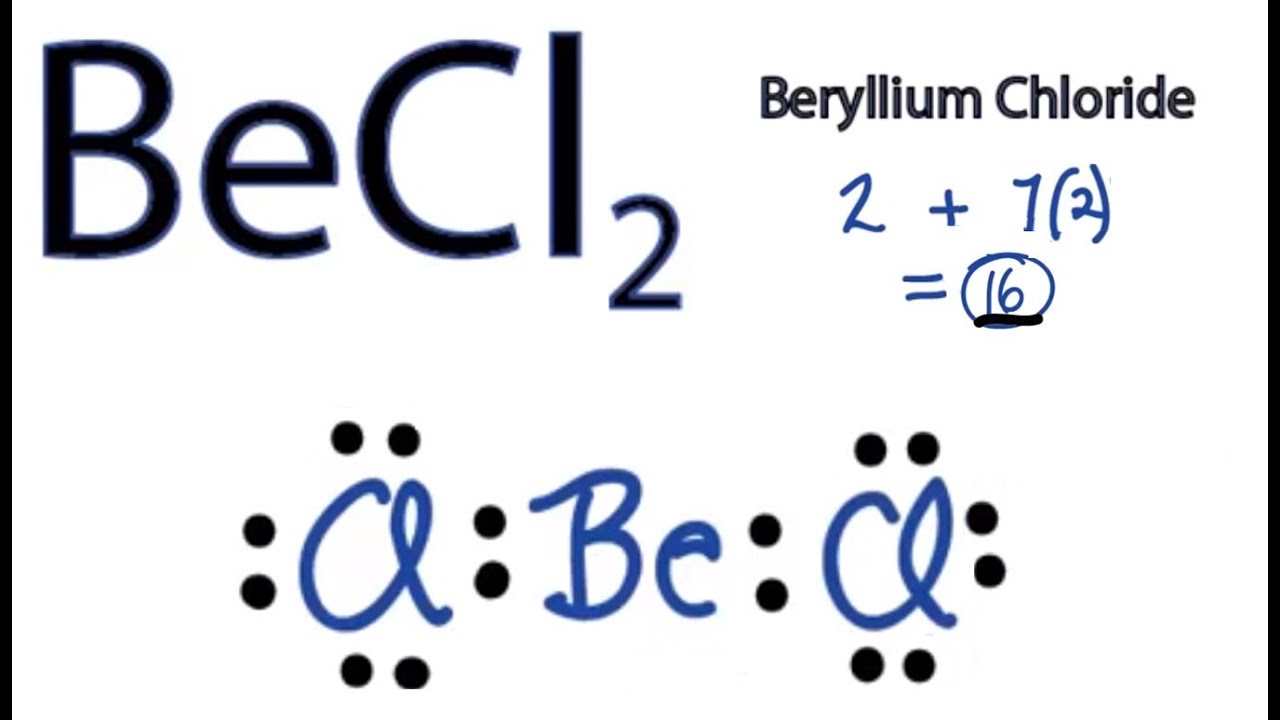

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
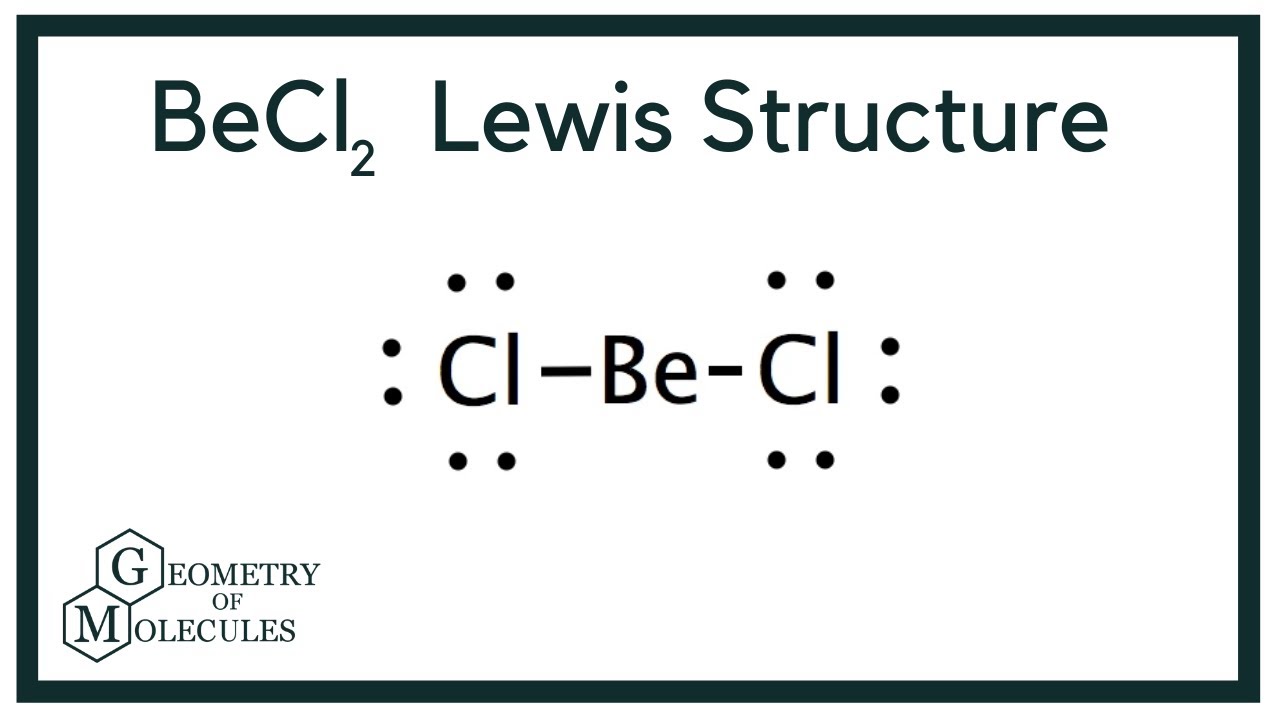
Cấu trúc Lewis của Beryllium Chloride (BeCl2) thể hiện beryllium ở trung tâm với hai nguyên tử clo liên kết với nó thông qua hai liên kết cộng hóa trị đơn. Beryllium chỉ có hai electron hóa trị, và mỗi nguyên tử clo đóng góp một electron để tạo thành liên kết. Do đó, không có cặp electron tự do nào trên nguyên tử beryllium. Điều này dẫn đến một cấu trúc phân tử tuyến tính với một góc liên kết 180°.
Vẽ Cấu trúc Lewis của BeCl2
Bước 1: Tính tổng số electron hóa trị
Beryllium (Be) thuộc nhóm IIA, có 2 electron hóa trị. Clo (Cl) thuộc nhóm VIIA, có 7 electron hóa trị. Vì vậy, tổng số electron hóa trị trong BeCl2 là 2 + 2(7) = 16 electron.Bước 2: Xác định nguyên tử trung tâm
Beryllium là nguyên tử ít điện âm nhất, vì vậy nó là nguyên tử trung tâm.Bước 3: Liên kết các nguyên tử
Mỗi nguyên tử clo tạo một liên kết đơn với nguyên tử beryllium, sử dụng 2 electron. Điều này sử dụng 4 trong tổng số 16 electron.Bước 4: Phân bổ các electron còn lại
16 - 4 = 12 electron còn lại. Mỗi nguyên tử clo cần 6 electron nữa để đạt được octet. Phân bổ 6 electron cho mỗi nguyên tử clo.Bước 5: Kiểm tra quy tắc octet
Beryllium chỉ có 4 electron xung quanh nó, không tuân theo quy tắc octet (ngoại lệ). Tuy nhiên, clo đạt được octet.Bước 6: Hình dạng phân tử
Do beryllium không có cặp electron tự do, hình dạng phân tử của BeCl2 là tuyến tính. Kết luận: Cấu trúc Lewis của BeCl2 là một cấu trúc tuyến tính với hai liên kết đơn Be-Cl và không có cặp electron tự do trên nguyên tử trung tâm. Đây là một ngoại lệ cho quy tắc octet.Xem thêm: vẽ tranh mùa thu
Sản phẩm liên quan: đề kiểm tra tiếng việt lớp 2 kết nối tri thức
Sản phẩm hữu ích: ch4 + gì ra c 2 h 2
Sản phẩm hữu ích: nhảy mũi 1 cái 2 cái điềm báo gì