Al + HNO3 loãng tạo NO2: Phản ứng và điều kiện
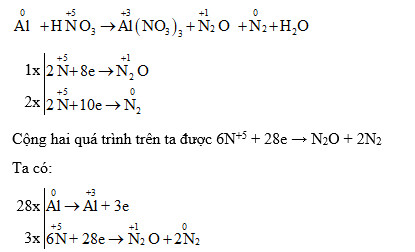
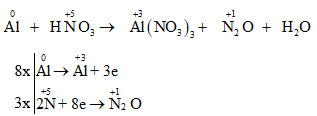
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Al + HNO3 loãng: Không tạo NO2
Câu trả lời ngắn gọn cho câu hỏi "Al + HNO3 loãng ra NO2?" là: Không. Phản ứng giữa nhôm (Al) và axit nitric (HNO3) loãng không tạo ra nitơ đioxit (NO2). Điều này khác hoàn toàn với phản ứng giữa Al và HNO3 đặc, nóng.
Sản phẩm của phản ứng Al + HNO3 loãng
Khi nhôm phản ứng với axit nitric loãng, sản phẩm chính là muối nhôm nitrat (Al(NO3)3) và khí nitơ monoxit (NO), cùng với nước. Phương trình phản ứng cân bằng có thể viết như sau:
8Al + 30HNO3 (loãng) → 8Al(NO3)3 + 3N2O + 15H2O
Hoặc có thể tạo ra khí amoni nitrat (NH4NO3) tùy thuộc vào nồng độ axit và điều kiện phản ứng:
8Al + 30HNO3 (loãng) → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Như bạn thấy, NO2 không phải là sản phẩm chính của phản ứng này. Để tạo ra NO2, cần sử dụng HNO3 đặc, nóng. HNO3 loãng có tính oxi hóa yếu hơn nhiều so với HNO3 đặc nóng, do đó, sản phẩm khử của nitơ sẽ có số oxi hóa thấp hơn như N2O hoặc thậm chí NH4+.
Điều kiện cần thiết để tạo NO2 từ Al
Để thu được NO2 từ phản ứng của nhôm với axit nitric, cần phải sử dụng axit nitric đặc và nóng. Trong điều kiện này, HNO3 thể hiện tính oxi hóa mạnh hơn, dẫn đến việc tạo ra NO2. Phương trình phản ứng sẽ phức tạp hơn và phụ thuộc vào nhiều yếu tố.
Tóm lại, nếu bạn muốn tạo ra NO2, hãy sử dụng HNO3 đặc, nóng, chứ không phải HNO3 loãng.
Sản phẩm hữu ích: tô màu con trâu
Sản phẩm liên quan: muối kiềm như ý
Sản phẩm liên quan: luyện đọc tiếng nhật
Sản phẩm liên quan: tin học khoa học tự nhiên
Sản phẩm liên quan: khứa áo xanh chạy