Phản ứng của Al với H2SO4 đặc nóng: Sinh ra SO2 và H2S?
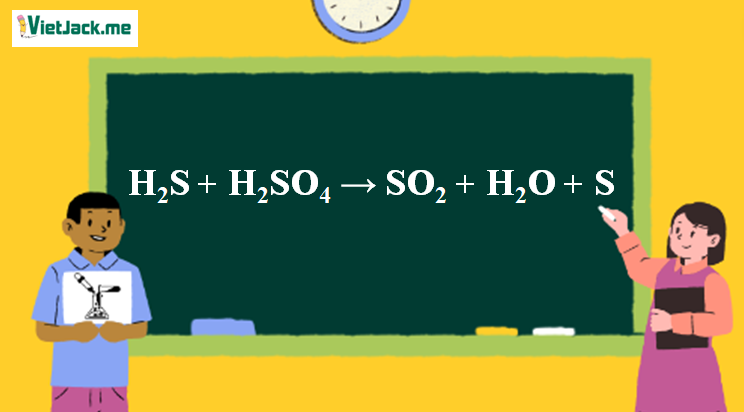
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng của nhôm (Al) với axit sunfuric đặc nóng (H2SO4) không tạo ra H2S. Sản phẩm chính của phản ứng này là khí SO2 và muối nhôm sunfat (Al2(SO4)3). H2S chỉ được tạo ra trong một số điều kiện đặc biệt và không phải là sản phẩm chính.
Phản ứng chính của Al với H2SO4 đặc nóng
Phương trình phản ứng:
2Al + 6H2SO4(đặc) → Al2(SO4)3 + 3SO2 + 6H2O
Trong phản ứng này, Al bị oxi hóa thành ion Al3+ và H2SO4 đóng vai trò là chất oxi hóa, bị khử thành SO2. Lưu huỳnh trong H2SO4 giảm số oxi hóa từ +6 xuống +4.
Điều kiện để phản ứng xảy ra
Phản ứng giữa Al và H2SO4 đặc nóng cần được thực hiện ở nhiệt độ cao. Axit sunfuric đặc có tính oxi hóa mạnh, đặc biệt khi được đun nóng, đủ mạnh để oxi hóa Al.
Vì sao không tạo ra H2S?
H2S là sản phẩm khử của lưu huỳnh ở mức oxi hóa thấp hơn (-2). Trong điều kiện phản ứng với H2SO4 đặc nóng, khả năng tạo ra SO2 (lưu huỳnh ở mức oxi hóa +4) cao hơn nhiều so với H2S. Để tạo ra H2S, cần phải có các điều kiện phản ứng đặc biệt khác, chẳng hạn như sự hiện diện của một chất khử mạnh hơn và điều kiện thiếu oxi. Việc tạo ra H2S trong phản ứng này là rất ít, nếu có.
Kết luận
Tóm lại, phản ứng chính của nhôm với axit sunfuric đặc nóng là tạo ra khí SO2 và muối nhôm sunfat. Việc hình thành H2S là rất hiếm và không phải là sản phẩm chính của phản ứng này.
Sản phẩm hữu ích: nhà thờ gỗ măng đen
Sản phẩm hữu ích: tiên official | tạo nếp gấp cho các điểm nối bằng thước kẻ
Sản phẩm liên quan: c6h5ch3 tên thông thường